毒蛇咬伤是一种容易忽视的疾病,每年造成全世界超过10万人死亡。毒蛇通过专门的毒牙注射毒液用于固定猎物,一口毒液足以杀死比蛇大很多倍的猎物。在进化过程中,蛇毒腺是从唾液腺进化而来。腺体上皮中分泌柱状细胞分泌一种复杂的多肽和蛋白质混合物,储存在管腔中,通过连接管道输送到毒牙。毒液毒素根据不同的作用方式可分类为不同的蛋白质家族,或可成为靶向人类蛋白质的药物来源【1】。蛇毒在毒素组成、产生和释放机制上有很大差异。蝰蛇(如响尾蛇)的毒液主要由血液毒性酶组成,而elapids(如眼镜王蛇)通常产生具有神经毒性作用的小肽。三指毒素(three-finger toxins,3FTxs)构成一种多样且高度表达的毒素类,主要通过与乙酰胆碱受体的相互作用发挥神经毒性作用。Kunitz型抑制剂(KUNs)虽然有些是抗凝剂,也具有神经毒性。磷脂酶A2(PLA2)蛋白可作为肌毒素或神经毒素,并显示抗血小板活性,而富含半胱氨酸的分泌蛋白(CRISPS)能阻断平滑肌收缩。蛇毒金属蛋白酶(SMPs)、L-氨基酸氧化酶(LAAOS)和C型凝集素(CTL)大多破坏凝血功能。然而,关于毒素的产生和释放周期、毒液产生细胞的异质性、影响毒液成分的因素等都需要进一步的研究。类器官(organoids)是从干细胞中生长,并基本再现组织基本特征的自组织3D结构,可用于科学研究。之前的研究显示无血清培养基中添加R-spondin、表皮生长因子和Noggin足以支持小鼠Lgr5+肠成体干细胞(ASCs)生长成不断扩张的上皮类器官,这些“迷你肠(mini-guts)”包含有所有已知肠壁细胞类型【2】。据报道,基于R-spondin的培养方案可用于多种健康和患病的哺乳动物的上皮细胞培养,而且Maimets等人证明了培养哺乳动物唾液腺类器官的可行性【3】。目前,我们对爬行动物的成体干细胞知之甚少,虽然已经构建出多种对蛇毒腺的短期培养系统,但能再现蛇毒腺结构和功能特性的长期培养系统尚未开发。
2020年1月23日,荷兰Hubrecht研究所的Hans Clevers在Cell杂志上发表文章Snake Venom Gland Organoids,成功构建了几种蛇类毒腺可长期培养的类器官培养系统。对Cape coral蛇类的转录组进行重新组装,揭示了类器官表达高水平的毒素转录物。对类器官和原代组织进行单细胞RNA测序鉴定出不同的毒液表达细胞以及表达已知哺乳动物干细胞标志物的增殖细胞,且类器官和原代组织的细胞组成具有类似性。类器官培养保持了个体毒液成分表达的区域异质性,而且毒液肽与粗毒液成分类似,且具有生物活性。
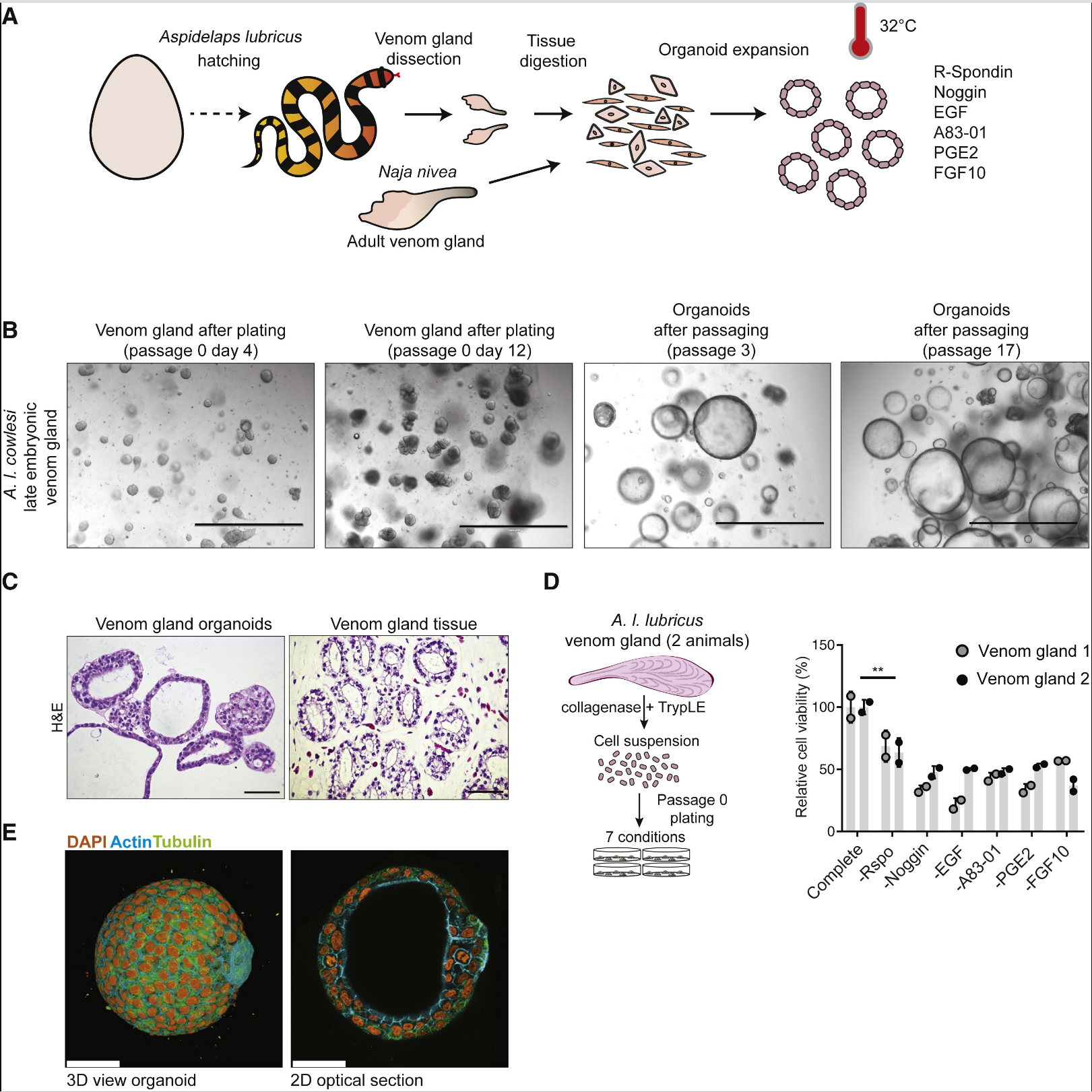
研究人员首先在32 ℃将9种不同蛇类的毒腺分离并嵌入到基底膜提取物种,添加“通用型”哺乳动物类器官混合培养基导致所有蛇类毒腺的类器官启动初始扩展,传代产生的扩张性类器官在组织学上类似于原始的腺体上皮。使用R-spondin(Lgr5的Wnt信号放大配体)、BMP抑制剂Noggin、EGF、小分子TGF β抑制剂A83-01、PGE2和FGF10进行培养,蛇毒腺类器官可得到最佳扩增,这与控制哺乳动物上皮类器官所需的细胞信号通路相同。类器官的培养需要在较低的温度下进行,这与蛇类身体温度较低有关。增殖细胞自动组织成囊性球体,有一个简单的极化上皮,偶尔观察到类器官的出芽,而且类器官传代超过20代其生长动力学或形态没有明显变化。去除所有的生长因子,7天后类器官的增殖减少,且含有高度极化的分泌囊泡,显示出分化的表型。将肝脏、胰腺、类器官的转录组与A.I. cowlesi(一种蛇类)重新组装的参考转录组进行对比,发现类器官转录组中毒素表达最为突出,而肝脏、胰腺则对应于器官特异性标志物。类器官表达的毒素中,3FTxs含量最为丰富,CRISPs、SVMPs、KUNs也有表达,而且这些毒素的相对丰度与毒腺组织中转录水平、粗毒液中蛋白质水平的组成相匹配。即A.I. cowlesi类器官表达了一个接近正常的毒液因子谱。为了探究成体毒腺类器官的长期传代能力,研究人员从成年Cape cobra蛇类(>1年)毒腺中培养类器官,其不但能再现上皮表型,而且能够传代超过18代,具有正常的分化能力和毒素表达情况。对A.I. cowlesi扩张型和分化型类器官、晚期胚胎毒腺的原代组织进行单细胞RNA测序。类器官细胞中共鉴定出12个细胞簇,扩张型和分化型类器官细胞基本上是分离的,根据3FTxs的表达确定出至少4个细胞簇能够产生毒液因子,且毒液产生细胞大多来源于分化型类器官。原代毒腺组织细胞中共鉴定出20个细胞簇,根据基因表达显示出53%为上皮细胞、27%为基质细胞、8%为造血细胞、7%为平滑肌细胞、4%为内皮细胞。3FTxs在2个上皮细胞簇中表达最高。类器官和原代组织中PDI和3FTxs具有共表达特性。扩张型类器官中,毒素表达细胞大多集中在细胞簇6-10,细胞簇7、8、9表达增殖标志物Ki-67、以及哺乳干细胞标志物RNF43、ASCL2、LGR5,这在原代组织中比较少见。添加R-spondin3增加干细胞标志物和Wnt靶基因的表达,而添加外源性Wnt3a进一步增加这些标志基因的表达。假时空分析显示,具有增殖祖细胞特性的细胞簇7、8、9处于假时间轴的起始,而细胞簇5和细胞簇1、2、3、4处于分化的两支。
哺乳动物器官的分泌细胞,如肠道,显示出不同种类的分泌细胞具有区域隔离特性。对A.I. cowlesi的蛇毒腺培养区域特定类器官,发现基因CTL在“近端”类器官中富集表达,而“远端”类器官主要表达3FTX、KUN毒素,使用RNA原位杂交在原代毒腺组织中验证其表达模式。CRISP在近端、远端毒腺中均匀表达,但偏好于基底而不是管腔细胞,这些数据显示出蛇毒腺中毒素表达的区域异质性。类器官分化7天后,检测到分泌囊泡的存在及管腔中明显积累的蛋白质,这表明分化的类器官大量产生分泌蛋白。利用LC-MS对比类器官提取物和粗毒液成分,发现两个样品在6-8kDa之间存在3个质量几乎相同的主峰,可能是3FTx和CRISP。类器官分泌的毒液可抑制细胞的钙信号传递,具有生物活性。

总的来说,研究将类器官技术扩展到爬行动物组织,建立了蛇毒腺的类器官长期培养系统,并证明了类器官具有干细胞特性、长期传代特性和分化能力,基本上再现了蛇毒腺的毒液表达特征,分泌的毒液具有生物活性,为研究蛇毒腺提供了新工具。
1. Fry, B.G., Vidal, N., van der Weerd, L., Kochva, E., and Renjifo, C. (2009). Evolution and diversification of the Toxicofera reptile venom system. J. Proteomics 72, 127–136.
2. Sato, T., Vries, R.G., Snippert, H.J., van de Wetering, M., Barker, N., Stange, D.E., van Es, J.H., Abo, A., Kujala, P., Peters, P.J., and Clevers, H. (2009). Sin- gle Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459, 262–265.
3. Maimets, M., Rocchi, C., Bron, R., Pringle, S., Kuipers, J., Giepmans, B.N., Vries, R.G., Clevers, H., de Haan, G., van Os, R., and Coppes, R.P. (2016). Long-Term In Vitro Expansion of Salivary Gland Stem Cells Driven by Wnt Signals. Stem Cell Reports 6, 150–162.




