类器官培养技术在再生医学中具有广阔的前景。类器官能够保持原有组织的关键功能和特征,具有用于组织修复的潜力。但是仅在动物研究中证明类器官移植入体内并存活下来,尚未在人体内证实类器官具有组织修复能力。
胆道系统可以将胆汁从肝脏转移至十二指肠。胆道异常的疾病占儿科的70%,但是用于肝移植的肝源紧缺,因此迫切需要治疗替代品。胆道系统的特征使其非常适用于类器官移植研究。胆道细胞可以很容易从胆管上皮获得。胆道细胞也类似于其他腔器官的特征,即沿着胆管树,胆管细胞表现出不同的独特的转录和功能特征。但是目前胆道树不同部位的胆道细胞衍生而来的类器官的再生能力还不清楚。
近日,Wellcome–MRC剑桥干细胞研究所Ludovic Vallier团队在Science上发表题为Cholangiocyte organoids can repair bile ducts after transplantation in the human liver的文章。该文章成功利用胆道类器官移植实现胆道再生。
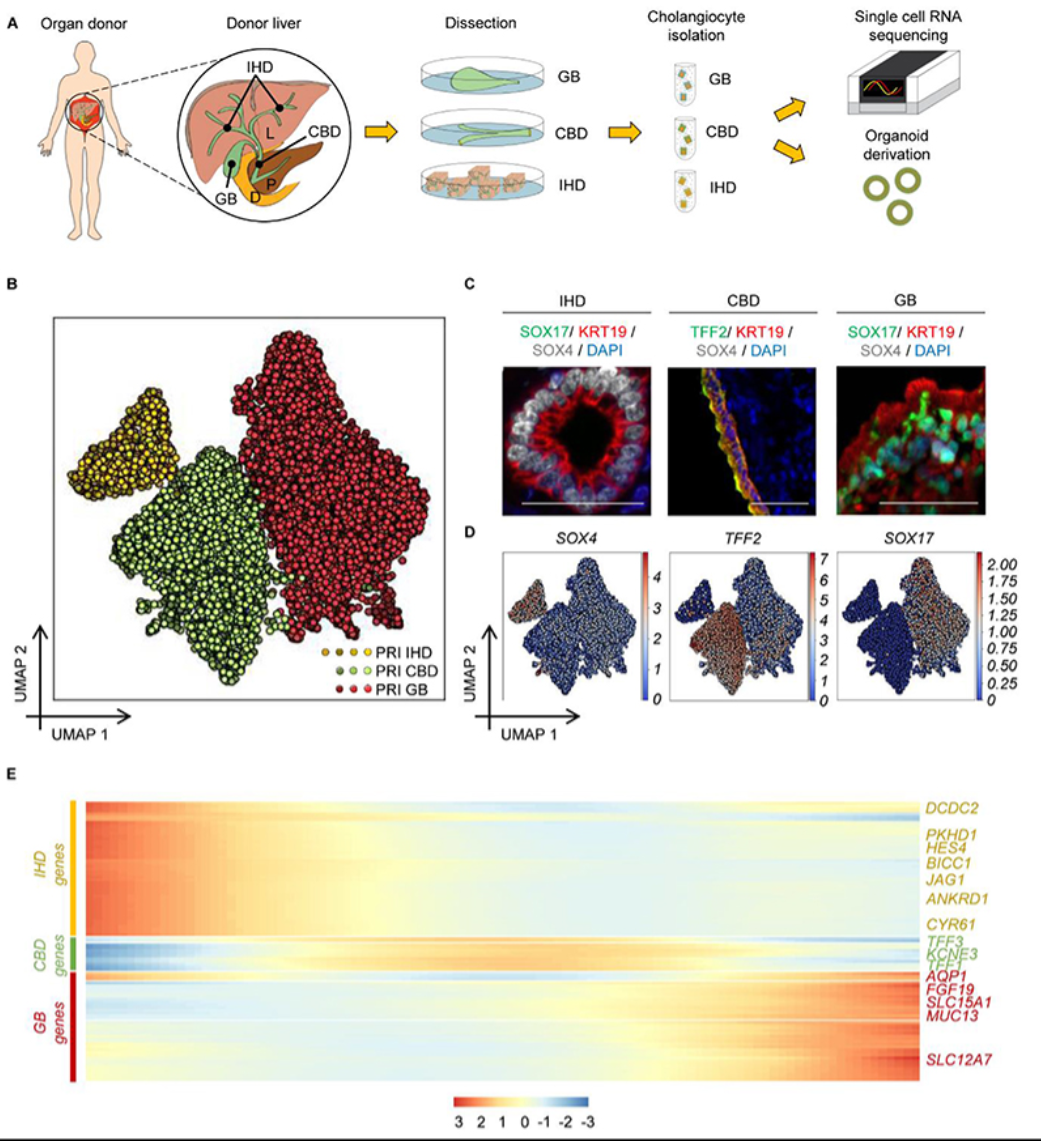
作者首先利用单细胞技术对人胆道树不同区域的转录组特征进行了分析,证实了胆道树不同区域,细胞转录谱不同。作者分离了肝内胆管、胆总管和胆囊的胆管细胞。三群细胞均具有核心转录谱,不同区域的胆管细胞具有独特的基因表达特征。基因表达特征对应于其功能,也反映出细胞适应微环境的特征。在胆管类器官中应用单细胞转录组分析却发现,细胞之间转录谱差异消失,转录谱出现重叠,表明体外生长的胆管细胞不再受原区域影响,而是适应新环境的变化。为了探究胆管类器官可塑性,作者通过将细胞在不同微环境中培养发现细胞的区域特异性可以通过外部环境诱导得到恢复。
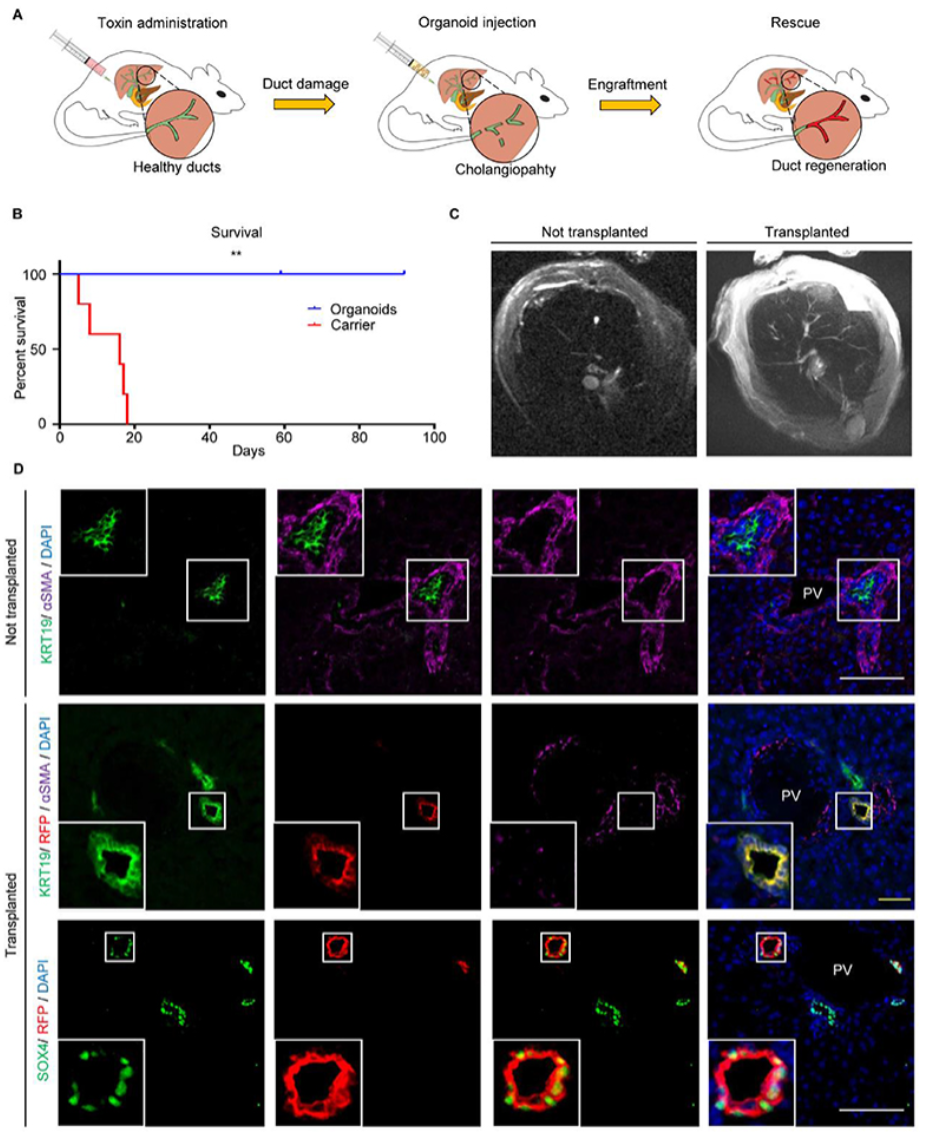
接下来作者使用胆管损伤小鼠模型来探究是否能够通过细胞的可塑性实现修复另一区域胆道树,从而推进基于类器官的器官修复技术进展。在免疫缺陷小鼠中通过MDA诱导胆管病变,对照组小鼠在三周内死亡,而给与胆管类器官小鼠则存活长达三个月。在大小不同的肝内胆管移植入类器官,约占再生胆管的25%-55%。作和检测发现并没有其他肝谱系标志物表达,表明胆管类器官的可塑性仅限于胆源系。作者使用间充质干细胞重复该实验,并不能改善小鼠生存状况,与对照组无明显差异,这说明管道疾病的再生治疗需要使用胆道细胞来源的类器官。
类器官移植组与对照组对比图
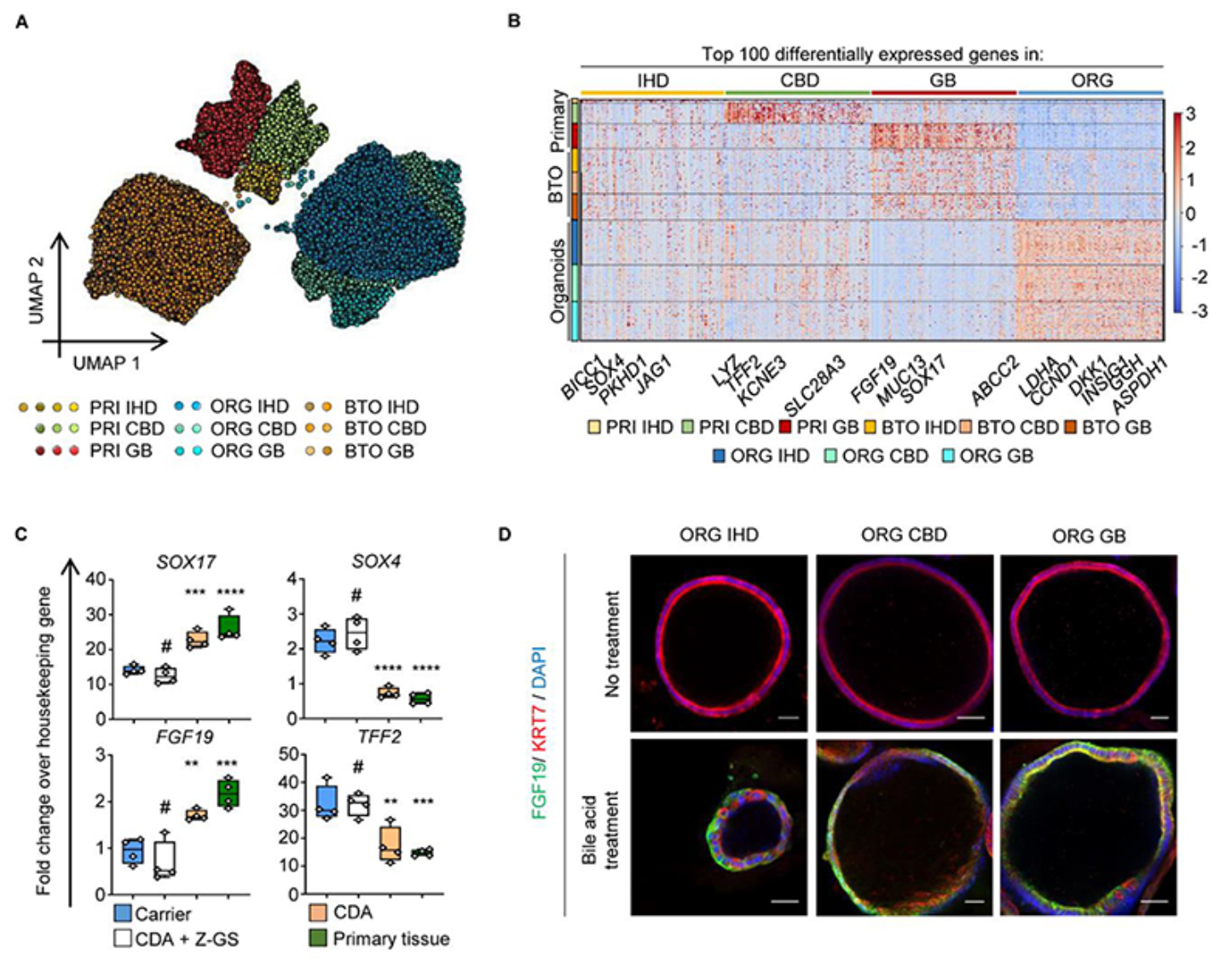
小鼠的移植实验有效,但并不能预测应用于人的效果。作者用离体常温灌注移植模型(cell transplantation in human organs undergoing ex vivo normothermic perfusion,NMP)来进行探究。NMP系统是为了改善器官保存效果,减少缺血再灌注损伤而设计的系统,可以将器官维持100小时接近生理的条件。通过在胆道类器官标记RFP,作者检测了移植类器官之后的变化。在注入的胆管树中,移植物再生率约40-85%,并且表达关键的胆管标志物。这也是第一次成功实现在人灌注器官中移植胆管类器官,促成胆管系统再生。
离体组织灌注模型中胆道类器官移植示意图
来自加州大学旧金山分校的Simone N. T. Kurial和Holger Willenbring为此研究发表了一篇题为Emerging cell therapy for biliary diseases的观点性文章。
他们指出细胞疗法具有替代肝移植的潜力,尽管困难重重,但是越来越多的研究都支持细胞疗法治疗肝内胆道疾病可行。更多的研究还需要解决植入细胞类型选择的问题,并需提高植入效率,并填补细胞治疗安全性方面的研究空白。本研究为首次成功实现胆道类器官移植应用于再生医学,为开辟类器官应用于人类的道路提供了试验的原型,加速了细胞治疗应用于临床的速度。






