最近两篇发表在《Nature》杂志上的文章向人们展示了科学家在类器官的帮助下解决Apc突变细胞在肠道肿瘤中的致病机制,并提出了有效的治疗措施。
肿瘤抑制基因Apc的突变以及其对WNT信号通路的竞争性抑制是导致肠道细胞癌变的主要原因。Apc是一种能够调节细胞增殖、迁移、粘着及染色体稳定的基因,其产生的Apc蛋白可以通过结合成复合物的方式降解相关蛋白维持细胞平衡。而WNT信号通路是通过配体蛋白WNT结合受体激发,由各种信号蛋白构成的复杂网络,参与胚胎发育,癌症以及各种生理过程的调控。这两种因素在肠道肿瘤的发生过程中起到重要作用。然而,关于其中细致的发病机制仍不明确,人们也无法找到有效的治疗靶点。由Eugenia Piddini等人于2016年发表在《Current Biology》期刊中的文章表明,Apc突变细胞在果蝇中比野生型细胞具有竞争优势。这篇论文显示,果蝇中肠中的Apc突变克隆已被证明能积极诱导周围组织的凋亡(图一)。
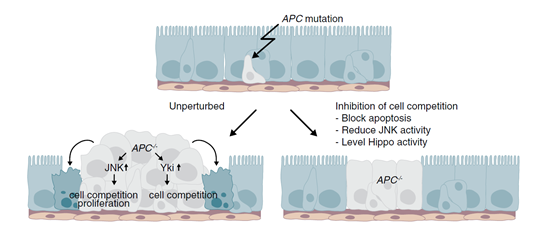
然而,以果蝇作为模型无法有效展现Apc突变在人体内发挥作用的过程。今年6月2日,Sanne M. van Neerven, Nina E. de Groot等人在Nature杂志发表了题为《Apc-mutant cells act as supercompetitors in intestinal tumour initiation》的论文。他们利用肠道类器官作为模型,有效模拟了人体器官的癌变过程,更加详细地解释了Apc突变基因如何发挥其竞争优势抑制肠道干细胞的正常作用,并为肠道癌寻找有效药物靶点提供了可能。

在肠道细胞的生态位中,WNT激动剂与拮抗剂保持着微妙的平衡,这种平衡对于肠道干细胞功能的维持以及适应肠道内壁的自我更新具有重要作用。而突变的肿瘤抑制因子Apc打破了这种平衡,研究表明Apc突变细胞比肠道干细胞更具竞争优势,并使肠道干细胞被无限制激活,诱导肿瘤发生。然而,在癌变过程中是否只涉及Apc突变细胞的内在特征,而突变细胞是否积极地对周围正常细胞进行消除并不明确。
为进一步探究Apc突变细胞如何发挥竞争优势,作者们建立了一种野生型与Apc-/-类器官共培养系统,并围绕所培育出的类器官展开研究。共培养体系有三种:1. 两种野生型肠道类器官共培养体系;2. 野生型/Apc-/-类器官共培养体系;3. Apc-/-细胞分泌因子培养基对野生型类器官进行培养。通过观察类器官生长状况,研究人员发现Apc突变类器官及其分泌因子在积极地抑制野生型类器官的细胞扩张及增殖(图二)。

图2. Apc突变细胞积极地抑制野生型类器官的生长
随后的转录组分析显示Apc-/-细胞分泌因子培养基中的野生型类器官分化细胞多(MUC2杯状细胞)于干细胞(Lgr5+细胞)(图2)。表明Apc突变细胞抑制增殖促进分化来抑制野生型类器官的生长和克隆形成能力。
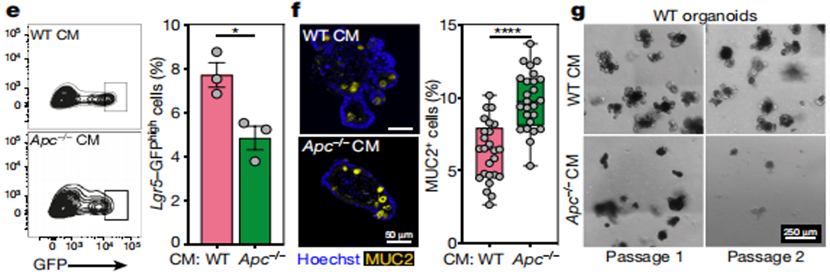
图3. Apc突变促进野生型细胞分化
转录组分析同样显示了WNT拮抗剂的上调,其中以Notum等因子最为突出。表明Apc突变同样会通过分泌WNT拮抗剂抑制野生型类器官的生长。
研究结果表明,持续的WNT通路信号导致一个有效的负反馈回路的激活,包括WNT拮抗剂的上调,在生理环境中可能调节WNT水平。而添加GSK3-β抑制剂、氯化锂等WNT激活剂激发WNT通路,抑制Notum等拮抗剂为肠道癌的预防与治疗提供了新的可能(图四)。

图4. 氯化锂中和Apc抑制能力,减少肿瘤形成
同一时间由Dustin J. Flanagan, Nalle Pentinmikko等人发表于Nature杂志的另一篇文章《NOTUM from Apc-mutant cells biases clonal competition to initiate cancer》同样借助于类器官对Apc突变引起的肿瘤发生进行研究,与前一项研究不同的是,这项研究详细揭示了Notum在其中发挥的作用。
 通过利用小鼠模型研究基因上调,转录组学分析以及免疫荧光染色,Notum是Apc突变细胞诱导肿瘤发生过程中最突出的因子。然而即使作为最优秀的实验动物,小鼠仍无法完美展现人体的生理过程,为了进一步研究,作者们选择在条件培养基中培养小肠类器官。在Apc-/-培养基中,与之前的研究一致,野生型类器官的生长受到抑制,其数量上的减少随时间推移更加明显,且干细胞标记减少,而分化标记增加,野生型类器官的数量在Notum抑制剂的添加后开始回升(图五)。
通过利用小鼠模型研究基因上调,转录组学分析以及免疫荧光染色,Notum是Apc突变细胞诱导肿瘤发生过程中最突出的因子。然而即使作为最优秀的实验动物,小鼠仍无法完美展现人体的生理过程,为了进一步研究,作者们选择在条件培养基中培养小肠类器官。在Apc-/-培养基中,与之前的研究一致,野生型类器官的生长受到抑制,其数量上的减少随时间推移更加明显,且干细胞标记减少,而分化标记增加,野生型类器官的数量在Notum抑制剂的添加后开始回升(图五)。

图5. Apc突变通过Notum的分泌抑制野生型类器官生长
而在Apc-/-/Notum-/-处理的培养基中,野生型类器官表现出与常规培养基中相似的生长动力学,而这种生长动力学在Notum的重新添加后发生逆转。
之后,作者们又通过β-catenin染色在小鼠模型中检测Apc突变个体的生长状况。结果表明,Notum通过直接抑制WNT信号传导和邻近干细胞的增殖并促进其分化来推动Apc突变克隆的扩张和固定;而Notum可以作为Apc突变导致的肠道肿瘤的治疗靶点,通过Notum抑制剂(NOTUMi等)进行疾病治疗(图六)。

图6. 对Notum的抑制减弱Apc突变细胞的影响以及肿瘤的扩散
两项研究展示的成果令人振奋,肠道肿瘤的研究在Apc突变细胞与WNT信号通路被发现后一度陷入研究的瓶颈,而如今科学家们利用类器官作为模型再次取得突破性成果,从细胞的相互作用与微环境出发,揭示了Apc突变细胞对下游WNT通路的影响,并由此发掘出新的肿瘤治疗靶点。相比于实验动物等生物模型,类器官能够完美重现人体器官及其生态位,这将使实验成果更快地转变为医疗手段。生物医学的未来属于类器官,相信在类器官技术的不断发展中,曾经无解的疾病将变得不再可怕!
参考资料:
1.van Neerven, S.M., de Groot, N.E., Nijman, L.E. et al. Apc-mutant cells act as supercompetitors in intestinal tumour initiation. Nature 594, 436–441 (2021).
2.Flanagan, D.J., Pentinmikko, N., Luopajärvi, K. et al. NOTUM from Apc-mutant cells biases clonal competition to initiate cancer. Nature 594, 430–435 (2021).











