2019年,新型冠状病毒SARS-CoV-2(严重急性呼吸综合征-冠状病毒-2)的出现导致了一场快速且仍在持续的全球性流行病。相关疾病也被称为新型冠状病毒肺炎2019(COVID-19),范围从无症状表现到严重的呼吸综合征,迄今已导致超过588万人死亡。
新型冠状病毒肺炎主要是一种肺部疾病,嗅觉、味觉的损伤是最明显的标志。然而随着病情的加重与调查的深入,大量证据显示其他器官同样受到SARS-CoV-2的影响,如急性肾损伤(acute kidney injury,AKI)的发生。
急性肾损伤的发生导致了新冠发病率与死亡率的提升,然而,目前尚不明确新冠病毒的感染是否会直接作用于肾脏并损伤相关细胞,AKI的发生可能是新冠患者的急性呼吸窘迫综合征的并发症,也有可能是因新冠的直接感染所引发。
2022年2月,来自德国亚琛工业大学的Jitske Jansen团队在Cell Stem Cell上发表了题为SARS-CoV-2 infects the human kidney and drives fibrosis in kidney organoids的文章,他们利用人诱导多能干细胞(Human induced pluripotent stem cells,hiPSC)培养的肾脏类器官直观地研究了SARS-CoV-2对人体肾脏的影响。

自新冠发生以来,有研究表明新冠病毒的感染与一些特殊蛋白及配体有关(如ACE2,TMPRSS2)。作者通过对患者肾脏样本进行染色对比试验,发现样本中SARS-CoV-2核衣壳蛋白存在于表达ACE2的近端小管上皮细胞质中。此外,肾损伤分子(kidney injury molecule 1,KIM1)以及肾的纤维化发生亦在染色中被观察到。(图1)

图1. 新冠患者肾脏样本染色结果
而作者之后进行的RNA测序、基因集合富集分析、应用路径反应基因进行活动推断、CellPhoneDB以及CrossTalkeR等分析检测到SARS-CoV-2感染相关基因PLCG2和AFDN,以及成纤维细胞中胶原蛋白、ECM糖蛋白和蛋白多糖的表达均出现增加,而近端小管细胞、足细胞和成纤维细胞以及这些细胞之间的相互作用均较正常细胞更加活跃。这些结果充分表明了SARS-CoV-2病毒对肾脏的直接感染,并导致了纤维化驱动通路的上调。
基于这些实验结果,作者使用hiPSC培养的肾脏类器官进行病毒感染测试,以研究病毒对肾脏最直接的影响,避免人体系统的干扰,获得最精准的数据。类器官的构建通过细胞培养过程中调控WNT激活剂CHIR99021的添加时间获得不同细胞,再以一定比例混合细胞以获得分段模式生长所必需的形态发生因素,最终在3D培养环境中获得所需类器官,并进行病毒感染。免疫染色验证了类器官存在肾单位样结构,而病毒RNA的表达证实了感染的成功。(图2)
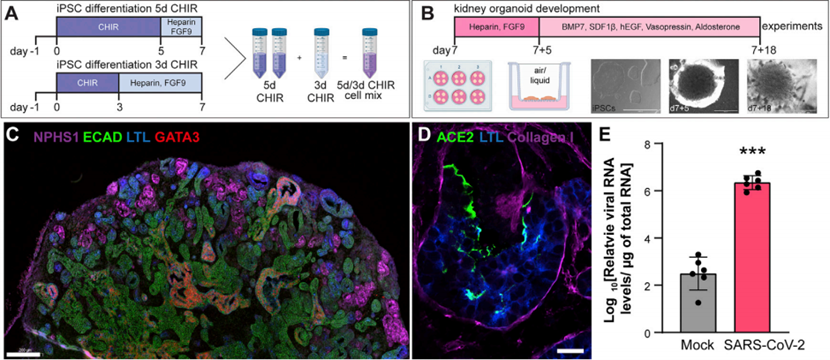
图2. 肾脏类器官的培养与验证
随后,对不同组织样本的免疫荧光染色证实了病毒的核衣壳蛋白在足细胞,近端肾小管上皮细胞以及基质细胞中的染色,并利用透射电镜成功鉴定了SARS-CoV-2核衣壳蛋白荧光阳性间充质细胞中病毒颗粒的超微结构。而免疫染色与Masson染色揭示了胶原酶I以及类器官纤维化程度的增加,显示了病毒感染引发肾脏纤维化的可能。(图3)
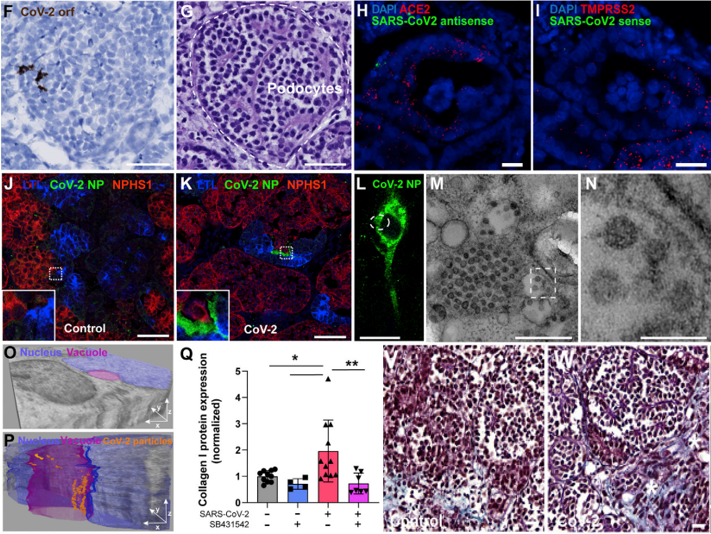
图3. 病毒感染后的组织染色
作者再次对肾脏类器官进行RNA测序以探究病毒的感染方式。结果显示,对照组和SARS-CoV-2感染的肾脏类器官样本之间的细胞类型分布总体上相似,然而,与对照组相比,感染的肾脏类器官显示出更多的神经细胞和足细胞,以及较少的肌肉细胞。此外,与之前的研究相似,作者在几乎所有的细胞群中都发现了SARS-CoV-2感染后PLCG2和AFDN的表达上调,且SARS-CoV-2基因在4%到25%近端小管细胞中和1.4%至18%的足细胞中检测到SARS-CoV-2基因的表达。这些结果表明,近端小管上皮和足细胞这两种重要的人肾细胞,可能是SARS-CoV-2感染中的主要感染位点。(图4)
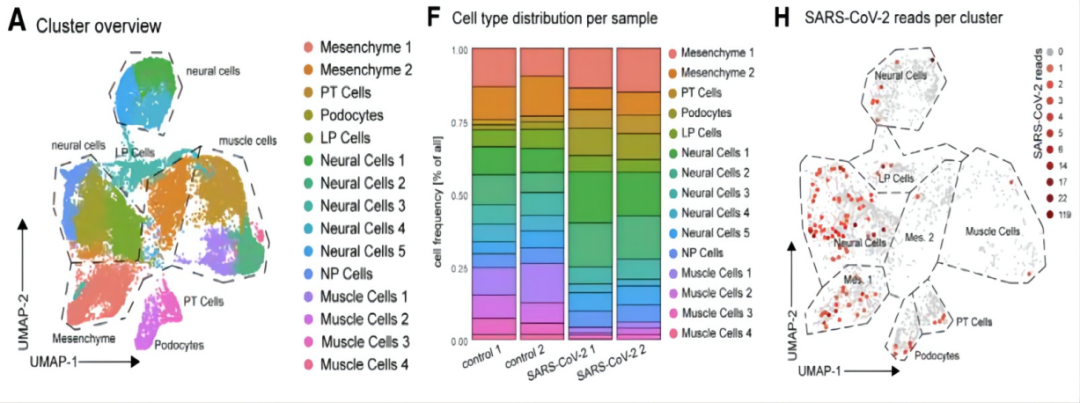
图4. SARS-CoV-2感染肾脏类器官的RNA测序
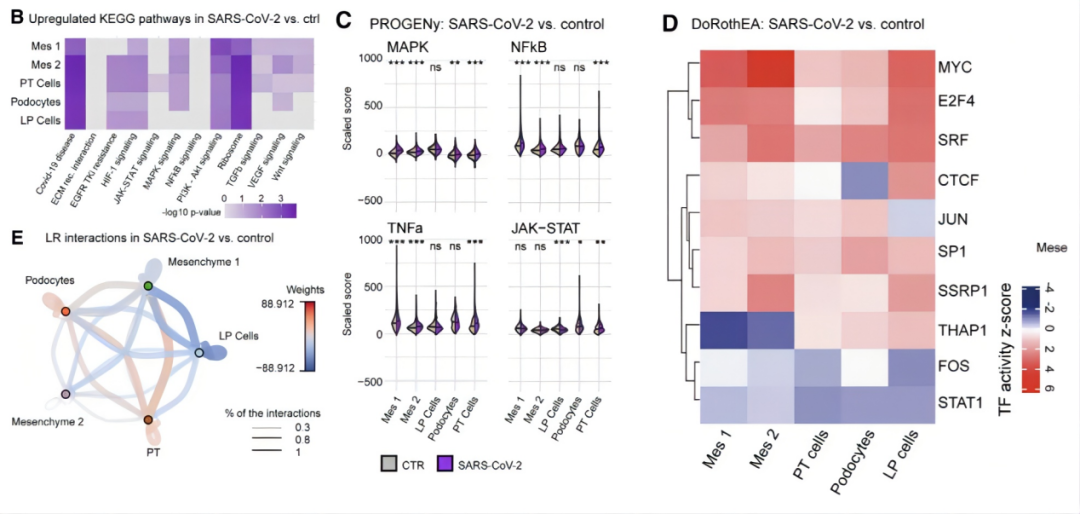
接着,作者对患者肾脏中观察到的纤维化损伤进行验证。KEGG通路分析显示,在近端小管细胞和间充质细胞中TGFb、PI3K/Akt、MAPK和WNT信号通路上调,这些通路在肾纤维化中发挥重要作用,而这些通路的上调均COVID-19病毒上调同在,表明了该变化由病毒感染引起;而利用PROGENy的检测同样显示了MAPK、NFkB、TNFa、WNT和TGFb等纤维化相关因子的活性增加;应用DoRothEA同样发现了近端小管细胞、足细胞和间充质细胞中MYC、E2F4、血清反应因子(SRF)、JUN和SP1活性增加;最后,CellPhoneDB和CrossTalkeR分析从细胞间相互作用出发,揭示了近端小管细胞与间充质细胞群之间以及足细胞与内皮细胞祖细胞群之间的细胞间互作对肾脏细胞纤维化的促进。综上结果所述,SARS-CoV-2感染引发了肾脏类器官的细胞损伤与去分化,并激活了促纤维化信号。这解释了新冠病毒如何破坏肾脏细胞,并引发急性肾损伤等伴发疾病。(图5)
新型冠状病毒SARS-CoV-2自发生以来在社会与经济方面对全球造成持续的影响,严重困扰了人们的生活和国家的发展。因此,为早日解决这一世界性难题,无数学者投身于研究之中。然而,仅凭临床数据或单细胞实验无法有效理解新冠病毒的发病原理或作用机制,前者无法避免整体对局部的影响,而后者无法有效揭示病毒对器官的损伤。
因此,本文所使用的类器官不仅有效避免了人体系统对单一器官的影响,而且有效模拟了肾脏的结构功能,使得实验数据能够精确显示病毒对人体最直接的影响。虽然类器官缺少免疫器官等部分功能,但其结果表明病毒感染至少部分独立于疾病或重症监护治疗的全身性影响,因此病毒感染可能直接导致肾脏的急性损伤和纤维化重构,从而导致肾功能下降并使得并发症产生。这篇文章通过类器官揭示了新型冠状病毒对肾脏的影响,为该病毒的研究以及并发症的预防提供了新的思路。









